労働衛生における生体リズムを考える –「時間毒性学」の紹介–
1.はじめに
現代社会は24時間社会であり、労働者は様々な時間帯に働いています。労働衛生学では、職場有害因子のばく露よる健康影響(障害)を考えていく必要がありますが、ばく露される時間(時刻)を考慮する必要があるのではないか、というのが私達の視点です。本コラムでは、ばく露時刻を考える理由、そして労働衛生学にこの視点を導入する意味・意義について、私達が得ているデータを含めてご紹介いたします。
2.労働衛生学と生体リズム
夜間勤務者および夜勤を伴う交代勤務者の割合は27.3%と報告されていて、就労者の約1/3が夜間も働いています。この割合は、業種によってはさらに上昇し、例えば鉄鋼業界では夜勤・交代勤務を採用する企業の割合は64.3%と報告されています 1)。このように、夜間勤務を伴う交代勤務は、現代社会において欠かすことのできない勤務形態となっています。
ところで我々「人間」をはじめとした多くの生物には、生体リズムが存在します。このリズムは、太陽や月の周期をもとに生物に備わった、生命の維持活動に必要なシステムと考えられています。生体リズムの長さ(周期)は「年」単位から「月・週・日・分・秒」単位まで様々で、本コラムでは「日」単位のリズム(概日リズムやサーカディアンリズムといいますが、ここでは「日内リズム」と呼びます)を対象とします。この日内リズムは睡眠や食事のタイミングをはじめとして様々な生命活動に関わることが分かっています(図1)。また病気の発症にも日内リズムがあり、例えば図2に示すように喘息発作は日中から宵の口ではほとんど生じませんが、明け方(午前3時–4時ころ)に劇的に増加することが分かります 2)。

図1 日内リズムの例
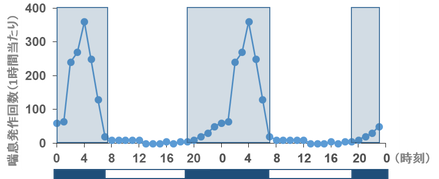
図2 喘息発作回数の日内変動
一方で、有害物質に対する生体防御系にも日内リズムが観察されます 3,4)。これはとても重要な点です。上述のように、交代勤務者は就労する時間帯が変動します。そのため、昼夜を問わず職場有害因子にばく露される、つまりばく露時刻が異なることになるわけです。従って、もしも生体防御機能が低下した時刻に有害物質のばく露を受けた場合には、生体影響(毒性)が強く生じるのではないかと私達は考えています。労働衛生学の目的の一つは労働者の健康確保です。そのため、職場有害因子(化学物質、物理的因子、環境要因)による労働者への健康障害を考える場合には、毒性学的な視点が必要となります。生体リズムを考える分野は「時間生物学」ですが、私達はこの生体リズムを毒性学に導入した「時間毒性学」を展開し、労働衛生分野への応用に取り組んでいます 5)。
3.ばく露時刻の違いによる毒性発現の強さの違い
では実際に私達の実験結果を紹介します。夜勤・交代勤務者の割合が鉄鋼業界で高いことから、金属化合物について、ばく露時刻の違いが金属の毒性強度に与える影響を調べました。毒性を人体で直接調べるわけにはいきませんから、動物実験で調べました。先ず、マウスに塩化カドミウム(CdCl2)を1回投与して、投与14日後までの生存数を調べました。投与方法は、朝10:00から4時間おきに時刻をずらして行い、投与時刻の異なる6群について行いました(10:00, 14:00, 18:00, 22:00, 2:00, 6:00に投与)。その結果、10:00に投与した群では投与14日後までに全てのマウスが死亡しましたが、驚くことに夜中の2:00に投与した群は逆に全てのマウスが生存しました(図3-a)6)。マウスは夜行性動物ですから、暗期(活動期)にCdに対する感受性が高く(=毒性が出やすい)、明期(休息期)に感受性が低い(毒性が出にくい)ものと考えられます。
Cdは急性毒性として肝臓障害を示します。そこで次に、致死を示さない量にまでCdCl2の投与量を落とし(投与は14:00または2:00に固定)、投与24時間後に肝障害指標である血漿中アラニンアミノトランスフェラーゼ(ALT)活性を測定しました。その結果、14:00投与群のALT値は1,000 IU/Lを超え、これはおそらく劇症肝炎を引き起こしているレベルと考えられました。ところが2:00投与群(=死亡が認められなかった時刻)では、ALT値は対照レベルでした(図3-b)6)。このことから、肝障害を指標とした場合でも、暗期(2:00)の投与ではCdは毒性を全く示さないことが確認されました。さらに、図には示していませんが、肝臓の病理組織解析では、この肝障害の結果と一致して、14:00の投与では肝臓中に多くの障害(壊死や出血など)が認められたのに対し、2:00投与群では対照群と変わらない正常な所見が観察されました。またその後の解析により、幾つかの生体防御因子の日内変動がCd毒性発現の日内変動に関わっている可能性を掴んでいます。この様な感受性時刻差を、私達は精巣障害 7)や免疫毒性 8)についても確認しています。
以上のように、投与時刻(=ばく露時刻)によって、金属毒性の強さが著しく異なることが分かりました。本コラムで紹介した結果は一つの例ですが、私達は色々な金属化合物が毒性発現の日内変動を示すこと、発現強度のピークは金属化合物によって異なる場合があること、一方で日内変動を示さない金属化合物もあることなどを明らかにし、現在整理を行っています。さらに、致死毒性や肝障害を示さないより低濃度のばく露について、鋭敏指標を用いた時間毒性の解析を進めています。
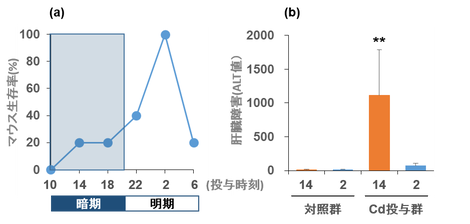
図3 時間毒性実験の結果
4.労働衛生学への「時間毒性学」導入の意義5)
私達は、毒性学に時間生物学的視点を導入した「時間毒性学」を展開し、この視点を労働衛生分野に取り入れたいと考えています。上述の第3項で、ばく露時刻によって金属毒性の発現の強さが著しく異なることを示しました。このことは、交代勤務などで作業時間帯が変動すると、ばく露時刻も多様になり、労働者の有害因子への感受性も変わる可能性を示しています。過去に、交代勤務労働者において、夜勤時のばく露の方が日勤時ばく露よりも有害物質に対して脆弱になるとの懸念が報告されていますが 9)、1990年代以降、生体リズムを考慮した研究は乏しい状態です。
労働現場は一般環境よりも有害因子(化学的、物理学的、生物学的)の取扱量が多いため、労働者にばく露される濃度(強度)が高い(強い)わけです。平時であれば、法規等に基づき職場で定めた管理濃度などに守られているはずが、例えば地震などの天災や人的ミスなどで漏れ事故や爆発が生じた場合、労働者は大量の有害因子のばく露を受けることになります。その時、それぞれの事業所で取り扱う有害因子についての時間毒性学的な情報が得られていたら、リスクマネジメントを考慮する題材となるのではないでしょうか。例えば、人で感受性時刻差の認められた有害因子があった場合、その感受性の高い(=毒性の出易い)時間帯には、1)その因子を扱わない、2)扱い量(強度)を減らす、3)確実に防護する、などの科学的根拠に基づいた注意喚起が可能となります(図4)。これにより、より精度の高いリスクマネジメントが可能となるのではと私達は考えています。
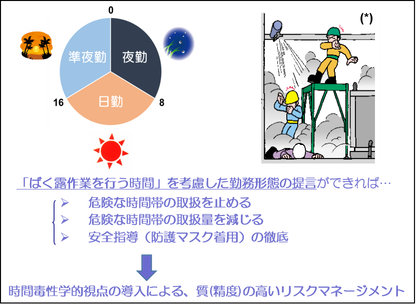
図4 労働衛生学への「時間毒性学」導入の意義
(*)「厚生労働省 職場の安全サイト事故事例」より一部改変して使用
5.おわりに
本コラムでは、トラブル時の突発的なばく露、つまり急性毒性(障害)について紹介しました。マウスは人間と違い夜行性動物であるため、得られた結果を人間に直接当てはめる(外挿する)わけにはいきません。感受性時刻差がなぜ生じるのか、その原因を突き詰めながら、リスクマネジメントを考察する題材に発展できるよう、実験研究を進めていきます。一方で、私達は生体リズムに着目した慢性影響(障害)についても調べています。本来、人が持っているリズムは、太陽が昇ると共に起きて太陽が沈むと共に休息(睡眠)に入るというリズムです。しかし現代は24時間社会であり、上述の交代勤務者をみれば夜間も起きていることになります。このような生活が続くと健康に悪影響が出てきます。これは夜間に光を浴びることによる生体リズムの攪乱が一つの要因と考えられています。実際、交代勤務により睡眠障害をはじめ肥満や高血圧、さらには発がんリスクの増大などの健康障害が疫学的に指摘されてきています。そこで私達は、交代勤務モデルを用いた動物実験を行い、新たな生体影響(精巣機能の減弱)についても観察しています。
このように私達は労働衛生学に時間毒性学的視点を導入し、多角的に労働者の健康を確保するための研究を進めています。
参考文献
- 厚生労働省. (2005) 平成17年就労条件総合調査(所定内深夜労働の内容別企業数割合)24表
- Dethlefsen U., and Repgas R., Arhiv za higijenu rada i toksikologiju, 80, 44-47 (1985).
- Miura N., Yanagiba Y., Ohtani K., Mita M., Togawa M., and Hasegawa T., J Toxicol Sci, 37, 191-196 (2012).
- Xu Y. Q., Zhang D., Jin T., Cai D. J., Wu Q., Lu Y., Liu J., and Klaassen C. D., PloS one, 7, e44237 (2012).
- 三浦伸彦、大谷勝己, 産業衛生学雑誌, 57, 21-25 (2015).
- Miura N., Ashimori A., Takeuchi A., Ohtani K., Takada N., Yanagiba Y., Mita M., Togawa M., and Hasegawa T., J Toxicol Sci, 38, 947-957 (2013).
- Ohtani K., Yanagiba Y., Ashimori A., Takeuchi A., Takada N., Togawa M., Hasegawa T., Ikeda M., and Miura N., J Toxicol Sci, 38, 145-150 (2013).
- Ohtani K., Ashimori A., Yanagiba Y., Yoshioka H., Hasegawa T., Hwang G., Ikeda M., and Miura N., Fund Toxicol Sci, 3, 237-242 (2016).
- Rutenfranz J., Bolt H. M., Ottmann W., and Neidhart B., Arh Hig Rada Toksikol, 40, 257-276 (1989).