化学物質のDNA損傷性を検出せよ!– 職業性発がん撲滅を目指して –
1.はじめに – 増え続ける化学物質と職業性発がん –
化学物質による職業性発がんの報告は、イギリスの外科医であったパーシヴァル・ポット氏の“煙突掃除人の陰嚢がん(1775年)”に端を発するといわれています1)。ポット氏は、ロンドンの煙突掃除人に陰嚢がんが多いことを報告し、“すす”がその原因であると指摘しました。後に、この“すす”の中に含まれていたベンゾピレンA)という化学物質がその発がん原因化学物質の一つであったことが示されています。
さて、ポット氏の報告から約2世紀半、現在、いったいどの位の数の化学物質が地球上に存在しているのでしょうか。世界最大の化学物質データベース(Chemical Abstracts Service: CAS)を提供するアメリカ化学会によると、2016年1月時点で、なんと1億500万種類以上の化学物質が登録されています2)。この数は2009年の時点では5000万種類でしたので、単純に計算しても1年間に1000万種類近い化学物質が、人類によって新たに合成(または発見)されていることになります。これは数秒に1個の勢いで化学物質が増えていると言え、このメルマガ記事を読み終わる頃には化学物質が数百種類増えていることでしょう。これら化学物質の内、現在、我が国で産業使用されている化学物質の数はどの位かというと、6万種類以上になると考えられており、この数も年々増加傾向にあります3)。 一方で、産業現場で労働者がばく露される可能性がある化学物質でその危険性・有害性が判明しているものはどの程度あるのでしょうか。昨年度の労働安全衛生法の一部改正によって、一定の危険性・有害性があると考えられる化学物質(524物質)は、従来の個別規制対象化学物質(116物質)に加えて、SDS (Safety data sheet) 交付義務、リスクアセスメント義務が課されるようになりましたが(2016年6月施行)、仮にこれら化学物質の危険性・有害性が全て判明したとしても、現在の産業使用化学物質の数からするとわずか1%程度であり、実際には、これら640種類の化学物質の中で、発がん性が判明、または示唆されているものは相当限定されます(図1参照)。すなわち、労働現場で使用される化学物質のほとんどは発がん性が不明であり、労働者は知らず知らずのうちに潜在的に発がん性を有する化学物質にばく露されている可能性を否定することはできません。ちなみに、2012年に大阪のオフセット印刷工場で胆管がんが発生した事例における原因化学物質であると考えられている1,2-ジクロロプロパンは一定の危険・有害な物質524種の中に入っていましたが、その発がん性は不明でした。
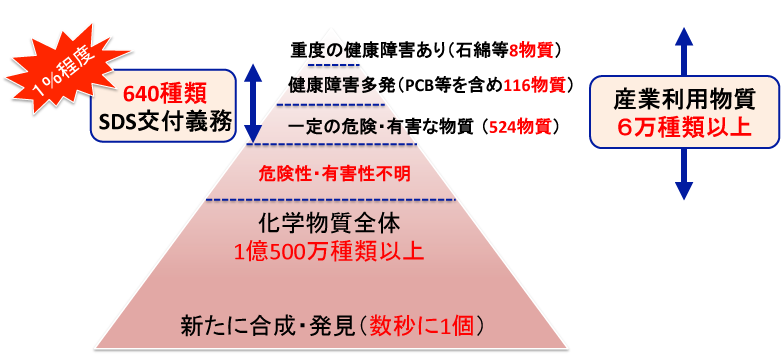
図1 増え続ける化学物質
化学物質による発がんは、急性毒性とは異なり、その原因物質にばく露されはじめてから影響が現れるまでに長い年月がかかります。それでは職業性発がんの発生を予防するために、発がん性を有する可能性がある化学物質はどのようにして見つけ出せばよいのでしょうか。その手法の一つに“化学物質のDNA損傷性の有無を評価する”という方法があります。化学物質のDNA損傷性評価法はこれまでに、いくつかの手法が考案されていますが、本メルマガでは著者らが開発に取り組んでいる新しいDNA損傷性評価法の概念も含めてご紹介したいと思います。
2.化学物質のDNA損傷性と発がん性について
まず、はじめに、なぜ化学物質のDNA損傷性の有無を評価することが、発がん性を有する可能性がある化学物質をみつけることにつながるのかを簡単に説明します。やや乱暴な言い方ですが、化学物質の中には、私たちの体を構成する1つ1つの細胞の中にある生命の設計図ともいうべきDNAに結合したり、切断したりしてDNAを損傷してしまうものが少なからず存在します。DNAには細胞、ひいては個体が生きていく上で必要な情報が書き込まれているわけですが、その中には、がんの発生を抑制するための情報(がん抑制遺伝子)というものが存在します。このような重要な情報に傷がついてしまうと、その情報は機能しなくなってしまいます。これまでに様々な種類のがん抑制遺伝子が見つかっていますが、図2にはその1例として、細胞の増殖(細胞周期)をコントロールする役割を持つがん抑制遺伝子が傷ついてしまった場合のイラストを示しました。正常な組織では細胞が整然と並んでいますが、これは細胞同士が接触し、ある程度の密度になると、それ以上増えないようにがん抑制遺伝子がコントロールしています。しかし、このがん抑制遺伝子が傷ついてしまい、本来とは異なる情報に変わってしまうと、細胞増殖を制御できない異常な細胞(がん細胞)がどんどん増えてしまい、最終的にはがん組織になってしまいます。
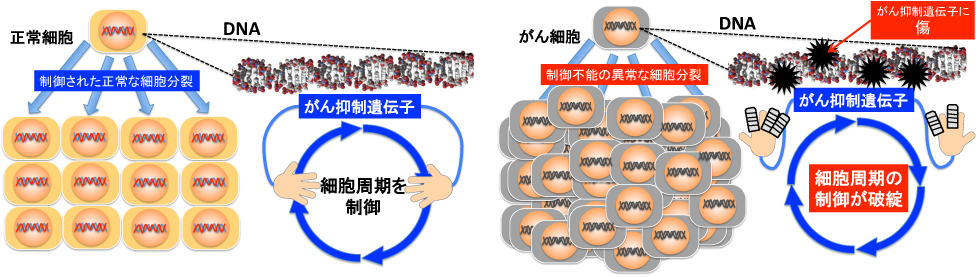
図2 がん抑制遺伝子の異常とがん
細胞の中には傷ついたDNAを修復する役割をもつ酵素も存在しますが、修復がうまく出来なかった場合、それが結果として発がんへの引き金(イニシエーション)になりうると考えられています。つまり、DNA損傷の発生は、発がんへのファーストステップを踏むということと言えます。もちろん、最終的な発がんに至るにはいくつもの複雑なステップ(条件)がありますので、必ずしも「DNA損傷性がある」=「発がん性がある」という図式が成立するわけではありませんが、「DNA損傷性がある」=「発がん性を有する可能性がある」と言うことはできると考えられますB)。実際に、これまで判明している発がん性化学物質の多くはDNA損傷性を有することが知られています。例えば、冒頭に記載したベンゾピレンはDNAに結合性の損傷を誘発することが明らかになっています4,5)。次項では化学物質のDNA損傷を検出する方法を紹介したいと思います。
3.化学物質のDNA損傷性の検出
化学物質が生成するDNA損傷は様々な種類がありますが、大別すると“結合系(付加体やクロスリンク等)”か“切断系(一本鎖切断または二本鎖切断)”に分けることができます。本稿では詳細は割愛しますが、“結合系”の損傷は、時間が経つと細胞内で“切断系”の損傷に変換されることが多くあります。現在、広く使用されているDNA損傷検出法はこの切断されたDNAを電気泳動して検出するというものです。代表例として図3にコメットアッセイ法の概念を示しました。この方法では、化学物質をばく露した細胞をアガロースゲル(寒天のようなもの)に封入し、いくつかの処理を加えた後に、スライドガラスごと電気泳動バッファー液に浸し、細胞に電流を流します。そうするとDNAはマイナスに荷電しているため、プラス電極に引き寄せられるようにDNAがゲル中を移動(泳動)します。このとき、短く切断されたDNAほど移動距離が長くなります。最後に特殊な蛍光試薬でDNAを染色し、蛍光顕微鏡で観察します。ある化学物質がDNA損傷性を有している場合、切断されて長い距離を移動したDNAが、彗星(コメット)の尾のようにみえます。この尾の長さなどを定量し、そのDNA損傷性を評価します。
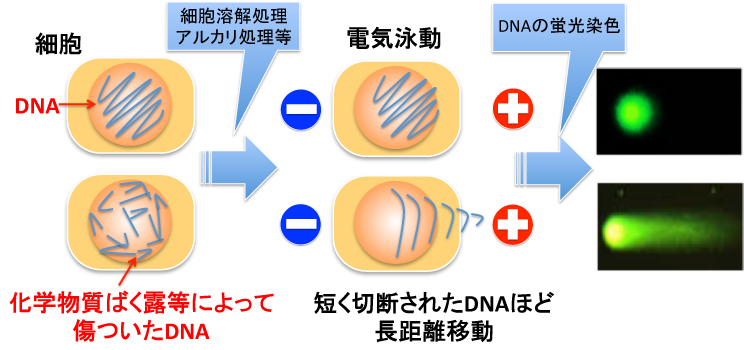
図3 コメットアッセイの概念
コメットアッセイは今から30年ほど前に開発された歴史あるDNA損傷性評価法であり、多くの研究機関で検証試験が行われ実績も十分にあるわけですが、この方法を実際に著者も行った中で、いくつか問題点が見えてきました。ひとつはDNA損傷の検出感度が期待するほど高くないということがあげられます(細胞死が引き起こされるような高濃度で化学物質をばく露しないと明確な結果を得ることが難しい場合が多い)。これでは、DNA損傷性を有する化学物質を見逃してしまうかもしれません。次に、作業が割と大変であるということです。これは個人の感じ方に違いもあるかもしれませんが、蛍光顕微鏡で取得した細胞の画像を専用ソフトで解析するだけでも結構な手間と時間がかかります。最後に多サンプル処理に不向きであると言えます。増え続ける化学物質に対応するには効率的に多種類の化学物質の検査が必須であり、理想的には多サンプル処理が可能な96ウェルプレートC)等で試験を行いたいところですが、コメットアッセイでは電気泳動の必要があり対応不可能です。このような点から、労働衛生分野においては、化学物質のDNA損傷性の評価にコメットアッセイでは対応しきれない場面がでてきていると著者は感じています。これらの問題点に対応すべく、現在、著者らは、“ヒストンH2AXのリン酸化”に着目した新規DNA損傷性評価法の開発に取り組んでいます。その概念を次項でご説明します。
4.化学物質のDNA損傷性評価のためのリン酸化ヒストンH2AXの応用
まずは聞き慣れない“ヒストンH2AX”について簡単にご説明します。私たちのDNAは細胞の中でヒストン8量体と呼ばれる球状のタンパク質複合体に巻きついて(約1.75周)存在しています(クロマチン構造)(図4参照)。このヒストン8量体はヒストンH2A、ヒストンH2B、ヒストンH3、ヒストンH4がそれぞれ2分子ずつ集まって形成されていますが、ヒストン8量体およそ5個のうち1個では、ヒストンH2Aと少しだけ構造が異なる(アミノ酸配列が少し長い)ものが含まれており、これをヒストンH2AXと呼んでいます。ヒストンH2AXには非常にユニークな性質があり、図4に示すように、DNAが切断されると、その切断部位を中心に、周囲に存在するヒストンH2AXが迅速にリン酸化(セリン139番目)と呼ばれる化学修飾がなされるという特徴があります6)。リン酸化されるヒストンH2AXの数は1つの切断に対して、およそ2000個と言われています。
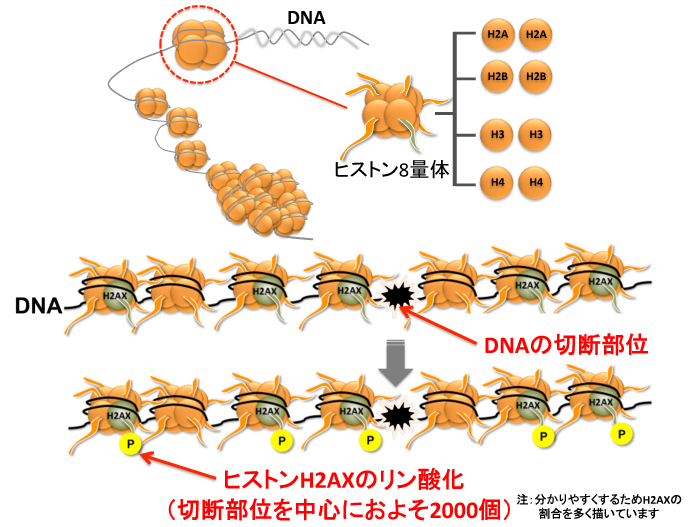
図4 ヒストンH2AXのリン酸化の概念
ヒストンH2AXがリン酸化する生物学的意義はまだ完全には明らかになっていませんが(説としては損傷を修復するための目印になると考えられています)D)、ここで重要なことは、このリン酸化されたヒストンH2AXを指標に、化学物質のDNA損傷性の評価ができるということです。リン酸化ヒストンH2AXの検出方法についてですが、ヒストンH2AXはタンパク質ですので、リン酸化ヒストンH2AXの検出には抗原抗体反応というものを利用します。リン酸化ヒストンH2AXを抗原として、これに結合することができる抗体を用いて、最終的には化学発光または蛍光でヒストンH2AXのリン酸化度合いを検出します。図5には例として、ある化学物質を作用させたときのヒストンH2AXのリン酸化を化学発光で検出したもの(左:ウエスタンブロティング法)と蛍光で検出したもの(右:蛍光免疫染色法)を示します。図5左ではバンドが太く濃いほどリン酸化強度が強いことを示しています。作用した化学物質の濃度が濃くなるにつれて、リン酸化強度が強くなっていることがわかります。また、図5右では、蛍光免疫染色を施し、蛍光顕微鏡でヒストンH2AXのリン酸化部位を観察したものですが、細胞核内でリン酸化したヒストンH2AXはドット状の蛍光として確認できます。このひとつひとつのドットでDNAの切断が生じていると考えられています。
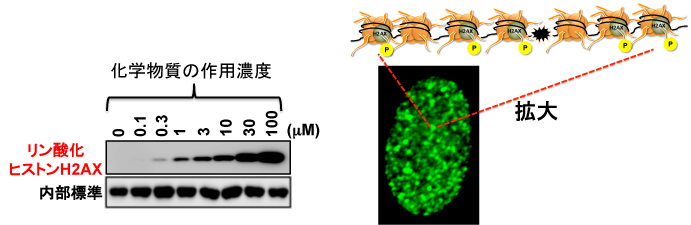
図5 化学物質ばく露によるヒストンH2AXのリン酸化
では、リン酸化ヒストンH2AXを指標としたDNA損傷の検出では、コメットアッセイのような従来法と比べて、どのような利点がでてくるのでしょうか。著者の経験も併せてその利点をあげると、まず、非常に高感度にDNA損傷性を検出することができるといえます。これは理論的に考えても、DNA電気泳動を原理とする従来法では、例えば1本のDNAに1つの切断がおきてもDNAは2本にしかなりませんが、ヒストンH2AXの場合、1つの切断に対して約2000個のH2AXがリン酸化されますので、この2000個のリン酸化ヒストンH2AXを検出する方が明らかに容易であるといえます。実際に、著者のこれまでの結果ではDNA電気泳動法よりも100-1000倍ほど高感度に化学物質のDNA損傷性を検出することができます(偽陽性が増えるということはありません)7,8)。次に、コメットアッセイでは電気泳動されたDNAの移動距離を1つ1つの細胞で測定する必要がありましたが、リン酸化ヒストンH2AXでは、基本的には細胞集団全体の化学発光強度または蛍光強度を測定すればよいので、解析が楽であるといえます。加えて、前述した通り、リン酸化ヒストンH2AXの検出は抗体抗原反応ですから、電気泳動の必要がなく、多サンプル処理が可能な96ウェルプレートなどで全ての試験を完結できるため、試験化学物質の高速多量処理が可能であると言えます。このことは労働現場で増え続けている化学物質のDNA損傷性を効率的に検査するのに大きな優位性があると考えられます。一方で、リン酸化ヒストンH2AXを指標に、発がん性を有する可能性がある未知化学物質を本格スクリーニングする前には、詰めておくべき課題がいくつか残されています。この場ではその詳細について言及しませんが、現在、著者らはH2AXシステムの本格運用に向けて様々なデータを蓄積しているところです。
5.最後に
リン酸化ヒストンH2AXの歴史は、コメットアッセイに比べるとまだまだ浅くE)、研究所間検証試験等もなされていませんが、近い将来、検証試験を経て化学物質のDNA損傷性評価のゴールデンスタンダードになると思われます。著者らは1日でも早いH2AXシステムの本格運用、ひいては職業性発がんの撲滅を目指すべく研究を進めていきたいと考えています
補足
(A) ベンゾピレンは多環芳香族炭化水素の一種で、石炭や石油等が燃焼した際に発生します。国際がん研究機関IARCの発がん性リスク一覧表では、最もリスクが高いとされるグループ1“ヒトに対する発がん性が認められる”にリストされています。
(B) 化学物質の中には、数としては少ないですが、発がんの一番初めのステップであるDNA損傷を生成せず、DNA損傷よりも後の発がんステップを促進するものも存在します(プロモーション作用と言われています)。このような性質をもつ化学物質は非遺伝毒性発がん物質と呼ばれています。
(C) 直径約0.5cmの井戸状の穴(ウェル:深さ0.5cm程)が96個あいているプラスチックプレート(縦9cm、横12cmほど)で、この中で細胞を培養したり、化学反応を行ったりすることができます。
(D) ヒストンH2AXがリン酸化することで、その部分一帯のクロマチン構造が緩み修復分子を損傷部にアクセスさせやすくさせるためであると考えられています。
(E) ヒストンH2AXリン酸化現象は電離放射線を照射した細胞内の現象として、もともとは1998年に発見されました6)。2005年頃に、この現象にスポットライトがあてられ、それ以来、放射線生物学関連分野を中心に新しいDNA損傷マーカとして注目を集めています。
引用文献
- John R. Brown and John L. Thornton. (1957) Percivall Pott (1714-1788) and Chimney Sweepers' Cancer of the Scrotum. Br. J. Ind. Med. 14, 68?70.
- CASホームページ (https://www.cas.org)
- 労働衛生のしおり(平成26年度)
- Jernstrom B, Graslund A. (1994) Covalent binding of benzo[a]pyrene 7,8-dihydrodiol 9,10-epoxides to DNA: molecular structures, induced mutations and biological consequences. Biophys Chem. 49, 185-199.
- Danford N. (1991) The genetic toxicology of ortho-toluidine. Mutat. Res. 258, 207-236.
- Rogakou EP, Pilch DR, Orr AH, Ivanova VS, Bonner WM. (1998) DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139. J. Biol. Chem. 273, 5858-5868.
- Toyooka T, Ishihama M, Ibuki Y. (2011) Phosphorylation of histone H2AX is a powerful tool for detecting chemical photogenotoxicity. J. Invest. Dermatol. 131, 1313-1321.
- Toyooka T, Ibuki Y. (2006) New method for testing phototoxicity of polycyclic aromatic hydrocarbons. Environ Sci Technol. 40, 3603-3608.
(健康障害予防研究グループ 任期付研究員 豊岡達士)