精子分析法の進歩と新しい取り組み
1.はじめに
もう20年近く前の話なのですが、内分泌かく乱化学物質(いわゆる"環境ホルモン")の問題が社会的関心を呼びました。環境を汚染する物質がヒトの精子をも減少させてしまい、もしかすると人類が存続できなくなるのではないかというおそれが生じました。幸いそんなことはなさそうなのですが、現在でも職場で使われる金属、有機溶剤や可塑剤などによる精子への悪影響は懸念されています。
歴史をたどると、ローマ帝国時代にはもうすでに、重金属、特に鉛による生殖系への障害事例が生じていたことがわかっています。大量の鉛製品が生産されたことが原因とされています。比較的近年の労働衛生の分野では、1960-70年代に米やイスラエルにおいて薫蒸剤(農薬の一つ)として用いられていたジブロモクロロプロパン(DBCP)によって、製造業者および散布業者に無精子症の被害が生じた事例があります。また、1990年代には半導体の洗浄剤として用いられていた2-ブロモプロパン(2BP)を取り扱っていた労働者に、やはり無精子症の被害が生じました。これらの生殖障害事例は疫学調査が先行して行われていますが、それだけでは因果関係が明確にならず、動物実験が行われて最終結論が導き出されています。
筆者は、かつて科学技術庁(現文部科学省)振興調整費(H10-12年度)による内分泌かく乱化学物質の研究班に属したことがきっかけとなって、労働安全衛生分野における精子の分析法の活用に取り組むことになりました。研究に着手してみると、従来型の精子分析法(精子数、精子運動能、頭部を中心とした精子形態解析)は機械が高額であったり簡便さに欠けたりなどの点で普及性の乏しい面があったり、化学物質の特性に応じた分析法には必ずしもなっていなかったことが分かりました。
そこで、本解説では一般的なラット、マウスの精子分析法の概説をした上で、筆者が現在取りくんでいる精子尾部の形態解析法について述べることにします。ヒトの精子の場合には扱いが異なるため、ここでは直接述べませんが、方法論としてほとんどがヒトへも応用可能なものばかりです。
2.今まで行われてきた方法
1) 精子数
ラットやマウスの場合には精巣上体尾部の精子数を測定するのが最も普通です。成熟した精子がたまる場所であるため、データが安定していることがその理由です。計測法は、計算盤上に精子浮遊液をのせて顕微鏡下で精子数をカウントする目視法が最も一般的に行われていました。この方法は、高額な設備を必要としませんが、鮮明な画像が保存されていない限り、第三者による生データの検証ができない、施設間での比較ができない等の問題があります。この点は従来の血球計算盤ではなくMarkler Chamber、 Micro Cell、 Cell Vu、 2×CELL等といった、精子数計測のための統一された規格の計算盤を用いることにより、比較的改善はされているのですが、測定者の熟練度等により差が生ずることは否定できず、信頼性の高い結果を得ることが難しいという短所があります。
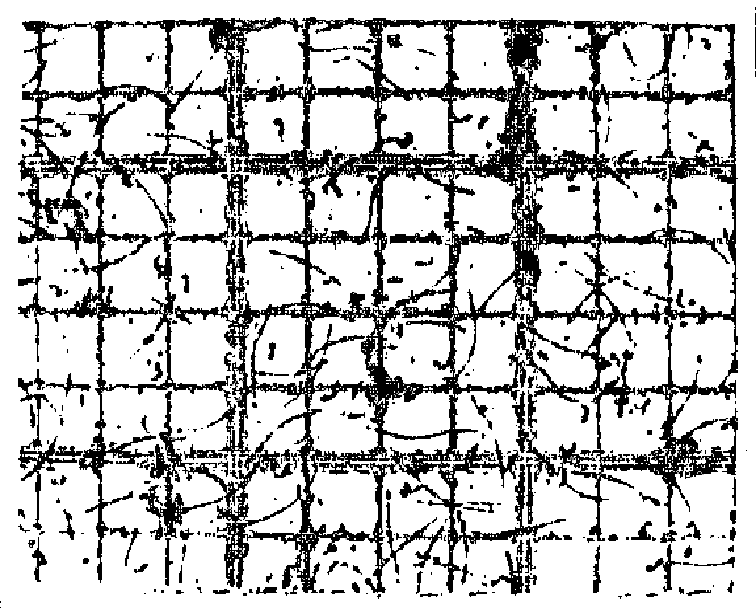
写真1 血球計算盤上の精子画像(精子とその他の夾雑物の区別が非常に難しい)
2) 精子運動能
精子運動能の検査については、精巣上体尾部から浮遊させた精子を、顕微鏡下で評価基準を基に観察者が主観的に判定するといった方法に終始していました。例えば、運動している精子と運動していない精子を肉眼で数え分け運動率を求める方法や、評価基準として、活力0–4という主観的基準を設けスコアをつけていくという方法があります。さらに、有名な方法として光川法といって顕微鏡下で計算盤上に精子浮遊液をのせて中央のスリットを通り抜ける精子をストップウォッチで時間を測りながら数え、単位時間当たりの通過精子数をもって運動能の指標とする等の工夫がされました。近年になって、コンピュータを用いた精子画像解析法(Computer-assisted sperm analysis: CASA )が運動能測定や精子数測定に利用されるようになりました。これは、画像解析により、精子の頭部を粒子として尾と区別させ、頭部の運動性や数をコンピュータに計算させる方法で、筆者も研究開始まもなく導入しました。

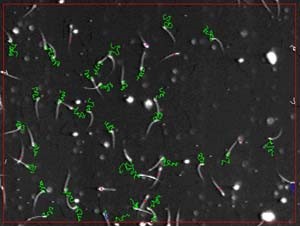
写真2 CASA(コンピュータを用いた精子画像解析法:左)とラット精子の運動の軌跡(緑の部分)(右)
3) 精子代謝能
精子にはミトコンドリアという構造が存在し、尾部に運動性を与えるために激しく活動しています。ミトコンドリア内の酵素の基質を発色させると生存精子数と正の相関を持つので、その発色の強さを測定して調べる方法が精子代謝能測定法です。この方法で調べた結果、ニトロベンゼンや2BPはラットの精子代謝能を低下させることが報告されています。
4) 精子頭部の形態
精子形態を検査する場合には上述の運動能や精子代謝能検査の様な迅速性(時間経過による変化)に留意する必要は無く、検体を保存して後日測定することが可能です。精子浮遊液をスライドガラス上に塗沫し染色し顕微鏡下で目視により観察することが一般的です(写真2)。精子の頭部は観察しやすいために化学物質による影響を検出するために用いられてきています。 しかしながら、精子頭部の形態は、化学物質を高濃度で投与しても変化が認められないことが多く、あまり鋭敏な方法とは考えられていません。
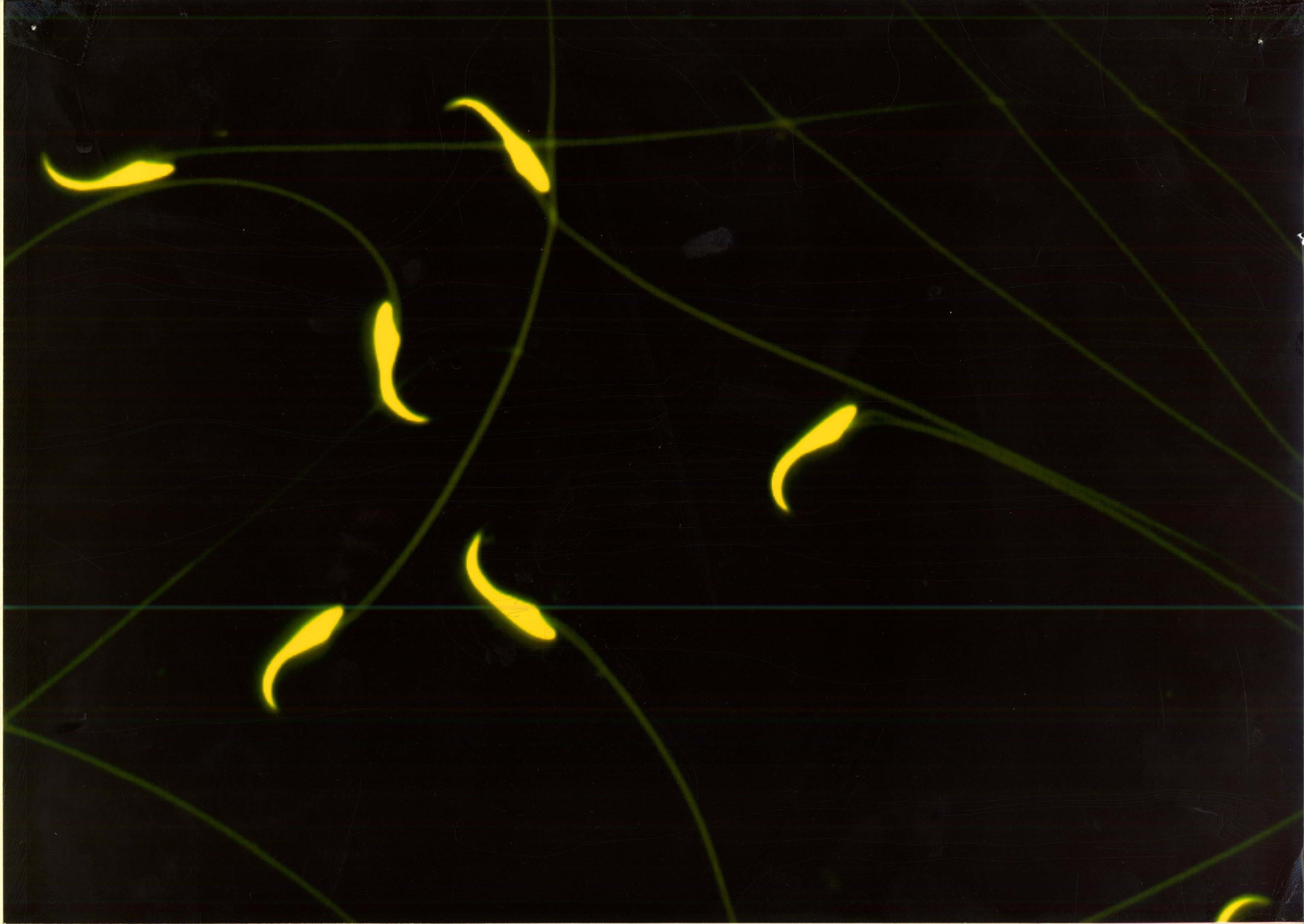
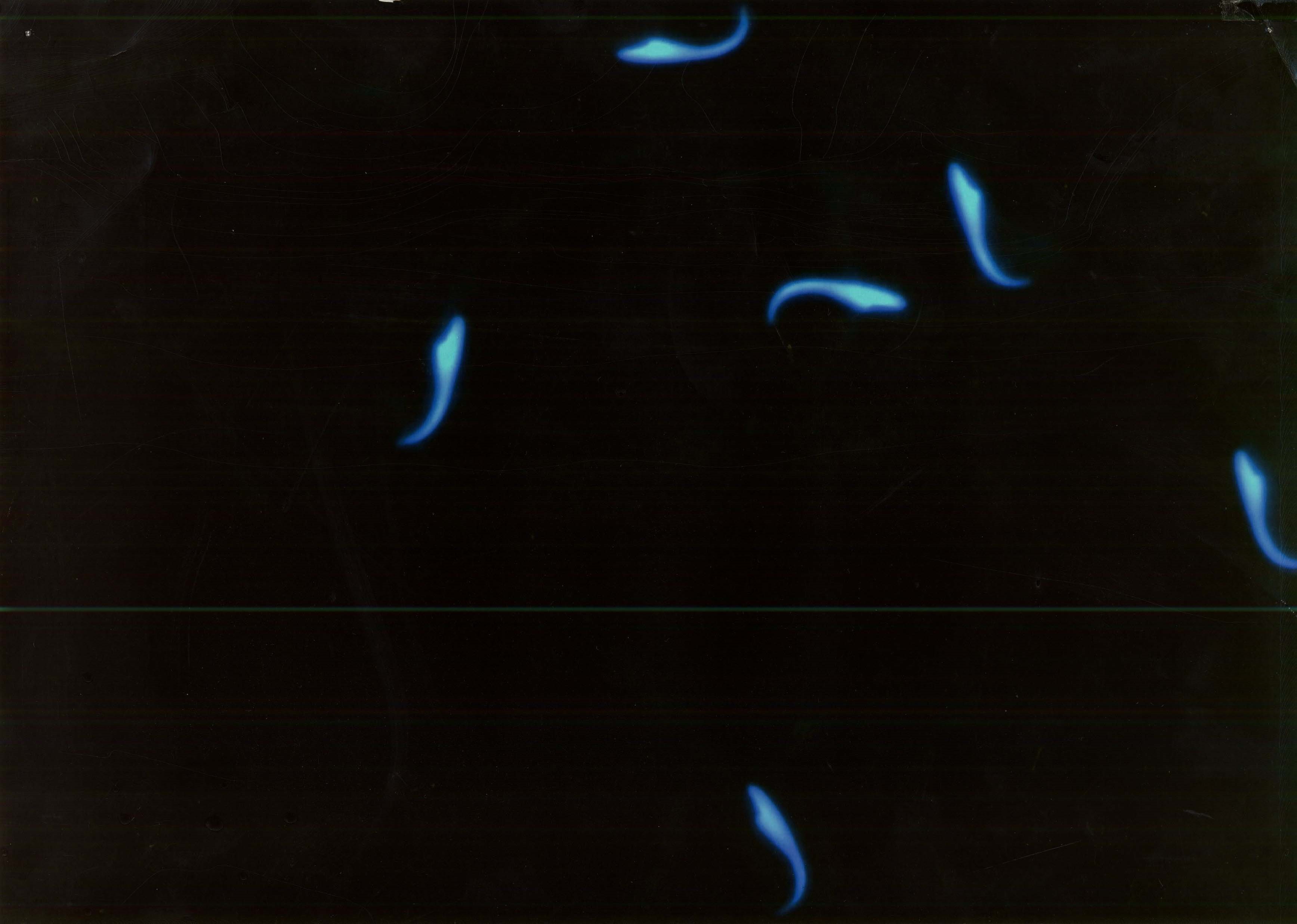
写真3 ラットの精子 アクリジンオレンジ染色(左)とベンズイミド染色(右)
5) 精子尾部の形態
現在、筆者が積極的に取り組んでいる「精子形態(特に精子尾部形態)の解析法」について述べます。精子尾部は頭部に比べて細いために観察しづらいため、あまり解析されていませんでした。しかし、CASAを用いているうちに、精子尾部の形態が容易に解析できることに気づき、応用を試みるようになりました。そして、精子の中には、細胞質の破片が尾部に残ってしまった未成熟なものがあり (写真4右)、化学物質を投与されたラットにおいて散見されるようになりました。しかしながら、従来の方法ではほとんど見つけることができません。また、尾の短い精子(写真4左:短尾精子)や、頭と尾が切れてしまった精子(写真5:離断精子)は、従来法では仮に見つけられたとしても、標本を作る際に生じたものとみなされてしまうことなりがちであまり注目されていませんでした。というのも、スライドガラスに精子の浮遊液を物理的に薄く広げる必要があり、さらに染色したり洗浄したりする作業があるためです。CASAによる画像は、そのようなアーチファクトがほとんどなくしかも容易に画像が取れます、短尾精子、未成熟精子の画像を写真4に示します。
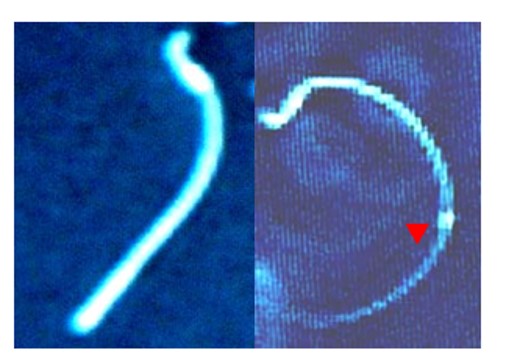
写真4 短尾精子と未成熟精子
短尾精子、未成熟精子の発生は、農薬として使われている有機リン殺虫剤DDVPやDZNを投与したラットでは、精子の数や運動性に変化の認められない用量でも、変化を見出すことが可能でした。さらに、DBCPを投与したラット精子の画像を写真5に示します。
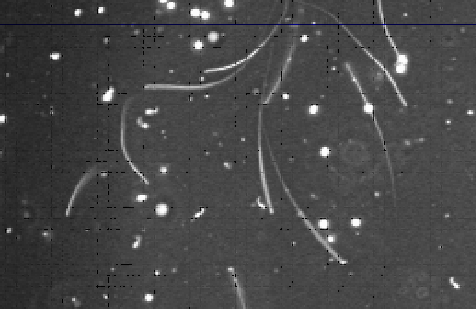
写真5 DBCP投与ラットの精子 (CASA拡大画像)全ての精子の頭と尾が切れている
DBCPの作用により頭部と尾部が離断している離断精子が多数認められ、運動能の低下もこれが原因で生じていました。また、写真は無いのですが、2BPをばく露した群では精子の数や運動性や変化のみとめられない低用量でも短形精子、未成熟精子の発生がみられました。このように精子の尾部形態では非常に微細な変化を見出すことが可能であり、今後の活用が期待されます。
3.おわりに
ここまで精子分析法について今まで用いられてきた方法を述べてきましたが、実は精子の分析法はまだまだ発展途上です。内分泌かく乱化学物質問題が起きてから研究者が増えたことにより確実に進歩はしているものの、次々と新たな問題が生じてきます。ここで紹介した精子尾部形態解析法でも、投与した物質の種類や量によって今までになかった新しい精子形態が現れてきます。たとえば首の折れた精子や膨らんだ大きな精子が発見されました。それらがなぜ生じるのか、精子として機能するのか、新たな問題となります。今後は、それらについても明らかにしていかなければならないと考えています。