なぜ反応が暴走するのか
化学反応において、急激に温度が上昇する暴走状態に至ることがあるのは、一般的に反応系の冷却速度が、ニュートンの冷却則に従って反応温度の一次に比例するのに対して、多くの化学反応では反応速度定数がアレニウス式によって示される指数関数的な温度依存性を示すことが原因です。
すなわち、反応が発熱的である場合には,何らかの要因で温度が上昇しはじめると反応速度が増大します。しかし、温度上昇に対して、発熱速度に比べ冷却速度はそれ程上昇せず、 結果として反応熱によって更に温度が上昇するという悪循環に陥ることになり、系の温度が急激に上昇し,暴走することになります。 このような反応暴走が起こる原因としては、外部冷却機能の喪失、反応溶液と冷却系との間の熱伝導不良(以上が外部要因)、原料の過剰投入による発熱速度の増加(内部要因)などが考えられます。
[ニュートンの冷却則]
冷却速度は、熱量Q、時間t、伝熱面積S、反応温度Tr、冷却系温度Tjとすると、以下のように表わされる。(注;αは総括伝熱係数)
)
[アレニウス式]
反応速度kは、mを反応量、tを時間、Eを活性化エネルギー、Rを気体定数、Tを絶対温度とすると、以下のアレニウス式で表わされる。 (注;k0は頻度因子)
)
ここで、単位当りの発熱量をqとすると、系の発熱速度は以下のように表わされる。
)
[反応温度と発熱速度、冷却速度の関係]
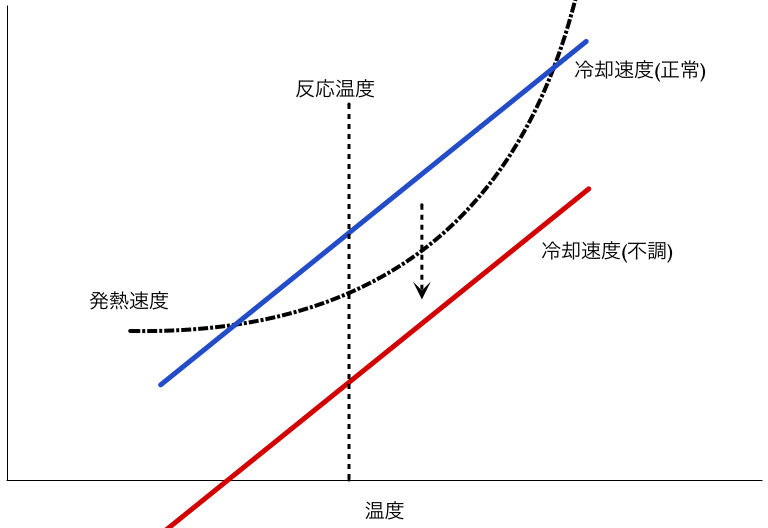
発熱速度と冷却速度の関係は、以下の図のようになる。充分な冷却能力があれば、反応温度において冷却速度が発熱速度を上まわるので、系の温度上昇を抑えることができるが、何らかの原因で冷却能力が減少すると、冷却速度が発熱速度を下まわり、系の温度が加速度的に上昇することになる。
すなわち、反応が発熱的である場合には,何らかの要因で温度が上昇しはじめると反応速度が増大します。しかし、温度上昇に対して、発熱速度に比べ冷却速度はそれ程上昇せず、 結果として反応熱によって更に温度が上昇するという悪循環に陥ることになり、系の温度が急激に上昇し,暴走することになります。 このような反応暴走が起こる原因としては、外部冷却機能の喪失、反応溶液と冷却系との間の熱伝導不良(以上が外部要因)、原料の過剰投入による発熱速度の増加(内部要因)などが考えられます。
[ニュートンの冷却則]
冷却速度は、熱量Q、時間t、伝熱面積S、反応温度Tr、冷却系温度Tjとすると、以下のように表わされる。(注;αは総括伝熱係数)
[アレニウス式]
反応速度kは、mを反応量、tを時間、Eを活性化エネルギー、Rを気体定数、Tを絶対温度とすると、以下のアレニウス式で表わされる。 (注;k0は頻度因子)
ここで、単位当りの発熱量をqとすると、系の発熱速度は以下のように表わされる。
[反応温度と発熱速度、冷却速度の関係]
発熱速度と冷却速度の関係は、以下の図のようになる。充分な冷却能力があれば、反応温度において冷却速度が発熱速度を上まわるので、系の温度上昇を抑えることができるが、何らかの原因で冷却能力が減少すると、冷却速度が発熱速度を下まわり、系の温度が加速度的に上昇することになる。